胸腺神经内分泌肿瘤病理学综述
定义
在2015年3月出版的肺、胸膜、胸腺和心脏肿瘤WHO分类中[1],肺和胸腺的NETs已经被纳入了新的分类方案,同样被分为低级别的TCs,中级别的ACs和高级别低分化的HGNECs,其中HGNECs包括LCNEC和SCLC。
胸腺瘤或胸腺癌很少与NET(通常是高级别的神经内分泌癌)同时发生。由于存在较大且位于中心位置的NETs,若其一侧浸润纵隔胸膜和肺,另一侧浸润纵隔组织(包括胸腺),则可能无法明确这些肿瘤的确切来源。事实上,没有任何单一的NET细胞标记物对肺或胸腺来源、甚或是胃肠胰腺的NETs纵隔转移具有绝对特异性(除了一些激素活性肿瘤)。
诊断标准
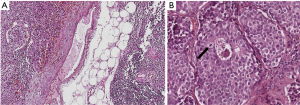
与肺部的情况不同,原发性胸腺类癌多为ACs,而TCs极为罕见。就肺部的NETs而言,单纯的形态学标准是识别不同组织学类型的唯一有效工具,需要结合结构(器官样或弥漫性生长)和细胞学特征(细胞大小、异型性、有丝核分裂计数、坏死程度)(图1A,B)。
除了上述两种类型的类癌外,LCNEC已从大细胞癌中分离出来而重新分类为一种NET,其定义为具有大的非典型性细胞,通常呈巢状和小梁状排列,有时形成菊形团样结构,细胞核不规则,染色质颗粒状,核仁明显[2]。常出现广泛坏死,核分裂计数超过10 / 10个高倍视野,即使在分化较好/出现器官样结构的病例中。由于激素分泌异常(通常为ACTH)引起的副肿瘤综合征,在胸腺LCNEC中也多有报道[3]。胸腺瘤或胸腺癌与NET并发的病例在胸腺中少见,其特征是一种NET成分同时伴有一种胸腺肿瘤类型。由于胸腺瘤和胸腺癌均可出现神经内分泌分化[4,5],因此在诊断该类并发肿瘤时,需要识别出其中两种肿瘤成分的形态学特征[6-8]。这种胸腺并发肿瘤的发病机制尚不完全清楚,尽管来自其他部位(如肺或胰腺)的遗传学数据大多显示两种成分的基因谱系相似,提示该类肿瘤是一种肿瘤向不同方向分化所致。
大多数诊断困境主要来自小活检或细胞学样本,其中少量的肿瘤细胞可能会阻碍正确的判读。尽管由于NETs具有特定的神经内分泌标记物,如突触素和嗜铬粒蛋白的表达,以及缺乏高分子量细胞角蛋白的表达,无论其位置如何,诊断可能并不困难,但在小活检或细胞学样本中明确组织学类型却并不容易,特别是从高级别的神经内分泌癌中鉴别出低级别的类癌。上述数据和我们的临床经验表明,最有用的诊断标志物是Ki67(据肺部的报道)[9]。这种标记物即使在有结构破坏的肿瘤区域也保持其核分布,这在活检中经常观察到,因而有助于区分类癌和HGNEC。
胸腺神经内分泌肿瘤尚无专门的分级系统,肺NETs分级标准对胸腺病变的预后价值尚未得到证实。
文献数据表明,尽管Ki67增殖指数的评估尚未正式纳入胸腺NETs的WHO判断标准(肺NETs情况也是一样),但它是预测其行为的一个可靠和有效的工具。实际中,Ki67已经被提议作为一个附加参数(结合两个“公认”的工具,即有丝核分裂计数和坏死)来分级肺NETs[10]。或许是由于病例的罕见性,有关胸腺NET分级的类似研究尚未开展。尽管如此,以4%和25%作为Ki67的判读截点,将肺NETs分为低、中、高三个级别的方式,似乎也适用于胸腺NETs。
遗传学
虽然最近发表了大量关于肺NETs的遗传学研究[11,12],包括NGS数据,但关于胸腺NETs的报道却很少被提及。在类癌中RB1和TP53突变并不常见,而已知MEN1突变伴随CDKN2A改变可发生在胸腺NETs中[13]。胸腺HGNECs(LCNEC和SCLC)与肺等其他部位发生的同类型肿瘤存在共同的基因突变,包括RB1、TP53、PTEN突变[14],以及MYC基因扩增[15]。在一项来自多家机构的73例遗传学研究中,分别收集了13例TCs,40例ACs和20例HGNECs。研究结果显示,每种肿瘤中染色体不稳定的平均数是增加的,从TCs的0.8到ACs的1.1,再增加到HGNECs的4.7(染色体异常病例的百分比也分别从TCs的31%到ACs的44%,再到HGNECs的75%)。在类癌和HGNECs中,最常检测到的遗传学改变是MYC基因位点(8q24)的增益[15]。此外,通过对9例伴有异位ACTH分泌综合征的胸腺NETs进行全外显子组测序,确定了3个可能与肿瘤发生有关的基因,分别是HRAS、PAK1 和 MEN1[16]。
预测性生物标志物
在肺和胃肠胰腺NETs中报道的对特异性治疗反应的预测因子(包括 mTOR 通路改变、YY1 突变和 SSTR 表达)[17,18] ,除了个别病例报告外,尚未在胸腺NETs中广泛研究。 对受体酪氨酸激酶抑制剂(舒尼替尼和伊马替尼)治疗的反应已在胸腺NETs中有报道[19,20]。mTOR通路抑制剂,如依维莫司,已经在多个部位发生的NET中展现出了疗效,似乎也有望应用于胸腺NETs[21]。近期,有研究检测了5种预测性生物标志物(CD52、CD22、CD26、EG5和IGF-1R)在5例胸腺类癌中的表达情况,但仅发现罕见的CD22和EG5表达[22]。
结论
尽管当前胸腺NET的分类方案反映了肿瘤的生物学特性,它与预后相关,在世界范围内被接受,并且为临床医生所熟知,但将肺、胸腺、胃肠道和胰腺的NET分类进行同质化或更好地整合才是广受期待的,至少在术语和组织学分类方面是如此。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors Mirella Marino and Brett W. Carter for the series “Dedicated to the 8th International Thymic Malignancy Interest Group Annual Meeting (ITMIG 2017)” published in Mediastinum. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/med.2017.10.06). The series “Dedicated to the 8th International Thymic Malignancy Interest Group Annual Meeting (ITMIG 2017)” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Travis WD, Brambilla E, Burke A, et al. WHO classification of tumours of the lung, pleura, thymus and heart. Lyon: International Agency for Research on Cancer, 2015.
- Boubacar E, Atsame-Ebang G, Rabiou S, et al. Thymic large cell neuroendocrine carcinoma - a rare and aggressive tumor: a case report. J Med Case Rep 2017;11:155. [Crossref] [PubMed]
- Saito T, Kimoto M, Nakai S, et al. Ectopic ACTH syndrome associated with large cell neuroendocrine carcinoma of the thymus. Intern Med 2011;50:1471-5. [Crossref] [PubMed]
- Weissferdt A, Hernandez JC, Kalhor N, et al. Spindle cell thymomas: an immunohistochemical study of 30 cases. Appl Immunohistochem Mol Morphol 2011;19:329-35. [Crossref] [PubMed]
- Weissferdt A, Moran CA. Neuroendocrine Differentiation in Thymic Carcinomas: A Diagnostic Pitfall: An Immunohistochemical Analysis of 27 Cases. Am J Clin Pathol 2016;145:393-400. [Crossref] [PubMed]
- Mizuno T, Masaoka A, Hashimoto T, et al. Coexisting thymic carcinoid tumor and thymoma. Ann Thorac Surg 1990;50:650-2. [Crossref] [PubMed]
- Sensaki K, Aida S, Takagi K, et al. Coexisting undifferentiated thymic carcinoma and thymic carcinoid tumor. Respiration 1993;60:247-9. [Crossref] [PubMed]
- Miller BS, Rusinko RY, Fowler L. Synchronous thymoma and thymic carcinoid in a woman with multiple endocrine neoplasia type 1: case report and review. Endocr Pract 2008;14:713-6. [Crossref] [PubMed]
- Pelosi G, Rodriguez J, Viale G, et al. Typical and atypical pulmonary carcinoid tumor overdiagnosed as small-cell carcinoma on biopsy specimens: a major pitfall in the management of lung cancer patients. Am J Surg Pathol 2005;29:179-87. [Crossref] [PubMed]
- Rindi G, Klersy C, Inzani F, et al. Grading the neuroendocrine tumors of the lung: an evidence-based proposal. Endocr Relat Cancer 2013;21:1-16. [Crossref] [PubMed]
- Peifer M, Fernández-Cuesta L, Sos ML, et al. Integrative genome analyses identify key somatic driver mutations of small-cell lung cancer. Nat Genet 2012;44:1104-10. [Crossref] [PubMed]
- George J, Lim JS, Jang SJ, et al. Comprehensive genomic profiles of small cell lung cancer. Nature 2015;524:47-53. [Crossref] [PubMed]
- Wood K, Byron E, Janisch L, et al. Capecitabine and Celecoxib as a Promising Therapy for Thymic Neoplasms. Am J Clin Oncol 2017; [Epub ahead of print]. [Crossref] [PubMed]
- Fernandez-Cuesta L, Peifer M, Lu X, et al. Cross-entity mutation analysis of lung neuroendocrine tumors sheds light into their molecular origin and identifies new therapeutic targets. AACR Annula Meeting 2014 American Association of Cancer Research. San Diego (CA), 2014:abstract #1531.
- Ströbel P, Zettl A, Shilo K, et al. Tumor genetics and survival of thymic neuroendocrine neoplasms: a multi-institutional clinicopathologic study. Genes Chromosomes Cancer 2014;53:738-49. [Crossref] [PubMed]
- Li Y, Peng Y, Jiang X, et al. Whole exome sequencing of thymic neuroendocrine tumor with ectopic ACTH syndrome. Eur J Endocrinol 2017;176:187-94. [Crossref] [PubMed]
- Zatelli MC, Fanciulli G, Malandrino P, et al. Predictive factors of response to mTOR inhibitors in neuroendocrine tumours. Endocr Relat Cancer 2016;23:R173-83. [Crossref] [PubMed]
- Volante M, Brizzi MP, Faggiano A, et al. Somatostatin receptor type 2A immunohistochemistry in neuroendocrine tumors: a proposal of scoring system correlated with somatostatin receptor scintigraphy. Mod Pathol 2007;20:1172-82. [Crossref] [PubMed]
- Dham A, Truskinovsky AM, Dudek AZ. Thymic carcinoid responds to neoadjuvant therapy with sunitinib and octreotide: a case report. J Thorac Oncol 2008;3:94-7. [Crossref] [PubMed]
- Hamada S, Masago K, Mio T, et al. Good clinical response to imatinib mesylate in atypical thymic carcinoid With KIT overexpression. J Clin Oncol 2011;29:e9-10. [Crossref] [PubMed]
- Ferolla P, Brizzi MP, Meyer T, et al. Efficacy and safety of pasireotide LAR or everolimus alone, or in combination in patients with advanced carcinoids (NET) of the lung/thymus: Results from the randomized, phase 2 LUNA study. Ann Oncol 2016;27:416O. [Crossref]
- Remon J, Abedallaa N, Taranchon-Clermont E, et al. CD52, CD22, CD26, EG5 and IGF-1R expression in thymic malignancies. Lung Cancer 2017;108:168-72. [Crossref] [PubMed]

戴顺东
医学博士,毕业于中国医科大学病理学与病理生理学专业,师从王恩华教授(前中华医学会病理学分会副主任委员、中华医学会病理学分会胸部疾病学组组长)。现为上海交通大学医学院附属第九人民医院病理科行政副主任,副主任医师。曾主持2项国家自然科学基金、1项高等学校博士学科点专项科研基金联合资助课题、1项上海交通大学“新型冠状病毒防治”专项软课题、1项辽宁省自然科学基金项目(优秀人才培育项目)、1项国家级大学生创新创业训练计划,参与国家自然科学基金3项。2019年获得全国高校(医学类)微课教学比赛 二等奖。现为中华医学会病理学分会胸部疾病学组委员、中国老年医学学会病理分会胸部疾病学组委员、中国医药教育协会肺部肿瘤专委会病理学组会员、卫健委住院医师规范化培训结业考核题库建设专家、教育部学位中心评审专家。(更新时间:2021/8/12)

杨文圣
副主任医师,病理学硕士,中国人民解放军陆军第73集团军医院(暨厦门大学附属成功医院)病理科主任。从业十多年,具有丰富的业务经验,擅长消化、呼吸、神经、乳腺、纵隔、男女性泌尿生殖、皮肤、骨与软组织以及淋巴造血等系统疾病的临床病理诊断与鉴别诊断。先后参与国家级及省级自然科学基金资助课题5项,并主持厦门市科技计划项目2项。至目前已发表学术论文50多篇,其中以第一作者及通讯作者发表SCI论文3篇、中文核心期刊论著20多篇,参编专著《感染病理学》、《进展期胃癌的个体化诊疗》等,并荣获第14届福建省自然科学优秀学术论文三等奖等。当前学术任职:中国研究型医院学会超微与分子病理学专业委员会委员,中国医疗保健国际交流促进会病理学分会委员,福建省科技厅引导性项目评审专家,福建省医学会病理学分会委员,福建省抗癌协会肿瘤病理专业委员会委员,福建省医师协会病理科医师分会青年委员会委员,福建省海峡医药卫生交流协会临床肿瘤学诊疗分会介入微创学组、神经内分泌肿瘤学组常务委员,厦门市医学会病理学分会副主任委员,厦门市病理质量控制中心常务委员,厦门市思明区人民法院医疗咨询专家库成员等。(更新时间:2022/11/18)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Bertero L, Metovic J, Vittone F, Cassoni P, Papotti M. Overview of the pathology of thymic neuroendocrine tumors. Mediastinum 2017;1:10.