与纵隔肿瘤相关的副肿瘤性神经综合征
介绍
纵隔肿块多见于前纵隔,包括几个实体瘤。前纵隔肿瘤更有可能是恶性的,更常见的包括胸腺瘤、淋巴瘤和生殖细胞肿瘤[1]。
纵隔肿块的临床表现可能与邻近结构的压迫或侵犯有关,在某些情况下会导致危及生命的紧急情况。在其他患者中,这些肿瘤可能是由PND引起的非局部症状预告。根据定义,这些疾病与肿瘤的组织侵袭、远处转移或癌症治疗的代谢/毒性效应无关。相反,它们被认为是由对肿瘤和靶器官(即神经系统和肌肉组织)共同表达的抗原的自身免疫反应触发的[2]。此外,与胸腺瘤相关的非神经系统的副肿瘤性疾病也广泛存在。副肿瘤性疾病的识别对于肿瘤诊断至关重要,并且可以预测特定类型的癌症。
在这里,我们将重点关注与胸腺瘤、淋巴瘤和胸部生殖细胞癌相关的PND。
胸腺瘤在自身免疫中的作用
免疫耐受可以定义为对自身或非自身抗原无反应的状态。胸腺是免疫耐受的中枢器官。祖细胞从骨髓迁移到胸腺,通过与皮质和髓质胸腺上皮细胞的相互作用而成熟和分化。在这一严格调控的过程中,T细胞经历阳性和阴性选择,并消除对自身抗原(自身免疫的潜在原因)具有高反应性的细胞[3]。 胸腺瘤起源于胸腺上皮细胞,根据世界卫生组织 1999 年发布的分类 [4] 和2004 年的修改 [5],胸腺瘤有不同的组织学亚型。
胸腺瘤相关自身免疫的致病机制与重症肌无力有关。在胸腺瘤的分子生物学和免疫细胞化学中已经描述了几种可以改变T细胞发育的异常。在MG相关胸腺瘤中,肿瘤上皮细胞仍然表达乙酰胆碱受体(AChR)亚基和肌联蛋白,但也显示主要组织相容性复合体(MHC)II类分子的表达减少,这是T淋巴细胞阳性选择所必需的。大多数胸腺瘤肿瘤细胞也不能表达自身免疫调节因子(AIRE),而AIRE是T细胞阴性选择的关键转录因子。此外,已有研究表明,胸腺瘤中抑制自身抗原免疫反应的调节性T淋巴细胞的产生减少[6]。
胸腺瘤相关的PND
神经科医生对胸腺瘤的兴趣最初是由它与重症肌无力的关系引起的。这种罕见的、生长缓慢的肿瘤是如何参与典型自身免疫性疾病的发病机制的,这一直是一个有争议的问题。后来,很明显胸腺瘤是一个更广泛的疾病谱的核心,我们从副肿瘤性MG中学到的为理解周围和中枢神经系统的PND机制铺平了道路。所有这些情况,以及非神经源性胸腺瘤相关的副瘤性疾病,也可以作为特发性非副肿瘤性疾病发生。
神经肌肉传递障碍
重症肌无力
MG是最常见的胸腺瘤相关疾病,因为多达40%的胸腺瘤患者发展为重症肌无力,而15%~20%的重症肌无力患者被诊断为胸腺瘤。
MG是一种神经肌肉接头疾病,由对抗突触后蛋白细胞外决定簇的抗体(Abs)引起。抗体攻击通过不同的机制导致形态和功能的改变,进而导致神经肌肉传递的损伤。
MG的临床标志是波动性肌肉无力,用力后加重,休息后缓解。在大多数情况下更常见的是某些肌肉群(外部眼、面、口咽、颈部、肢体近端肌肉)的受累为典型的临床表现。另一方面,虚弱的严重程度表现出显著的可变性,从纯粹的眼部症状到严重的全身性疾病。呼吸肌无力会导致呼吸衰竭(所谓的肌无力危象),需要辅助通气[7]。大约90%的重症肌无力患者血清抗体与AChR相当。这些抗体通过补体激活和增加AChR降解,以及在较低程度上通过干扰乙酰胆碱结合位点,诱导突触后膜的严重改变[8]。伴有乙酰胆碱受体抗体(AChR-MG)的MG常与胸腺改变有关,如滤泡增生和胸腺瘤,两者都在疾病发病机制中发挥作用[9]。
在抗AChR阴性患者中,可以检测到其他突触蛋白(如肌肉特异性酪氨酸激酶受体MuSK和低密度脂蛋白受体相关4 LRP4)的抗体,并识别不同的疾病亚型[10]。MuSK-LRP4-Agrin(突触蛋白聚糖)复合物对于成年人神经肌肉接头的形成和维持至关重要。神经分泌的突触蛋白聚糖通过其共同受体LRP4激活了MuSK,促进AChR聚集[11],LRP4传递有助于突触前分化的逆行信号[12]。5%~7%的抗AChR阴性患者有对MuSK的抗体,在低比例的抗AChR和-MuSK阴性病例中可以发现对LRP4的血清抗体,最近,血清免疫球蛋白G (IgG)对agrin已有报告[10]。此外,少数有MG临床和电生理体征的患者没有检测到Abs(血清阴性MG)。目前,没有数据支持所有这些形式的MG与胸腺的致病联系。
尽管已在MuSK-MG [13]、LRP4-MG [14]和血清阴性疾病[15]中描述了胸腺瘤的孤立病例,但与胸腺瘤的关联基本上仅限于AChR-MG。
胸腺瘤相关AChR-MG的临床和致病因素
在绝大多数患者中,MG的发作导致胸腺瘤的发现,因为通过计算机断层扫描对纵隔的研究是根据神经病学诊断常规进行的。更罕见的是,在胸腺瘤治疗后数月甚至数年出现 MG,可能是肿瘤复发的征兆。
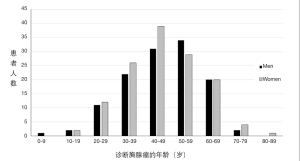
在重症肌无力患者中,前20年和70岁后发生胸腺瘤的风险较低;它在两者之间增加,在第4个到第6个10年中的发病率达到高峰。图1显示了我们机构1980~2016年间256例重症肌无力患者的胸腺瘤诊断年龄。如图所示,我国人口中没有性别偏见。这一发现在其他胸腺瘤相关的MG队列中也有报道[16,17]。
胸腺瘤相关的重症肌无力通常很严重,有很高的危及生命的症状,患者倾向于继续依赖免疫抑制治疗。在这些病例中,无论是肿瘤治疗前还是治疗后,都可能出现广泛的其他神经和非神经副肿瘤性疾病。这些疾病的发生以及重症肌无力症状的严重恶化都可能预示着肿瘤的复发,并应该进行特定的影像学研究。
AChR-MG患者的血清中通常含有巨肌蛋白肌联蛋白和兰尼碱受体抗体(RyR)。这些抗体,以前被称为抗纹状抗体,与MG相关胸腺瘤密切相关(95%的抗肌联蛋白呈阳性,70%的抗兰尼碱受体抗体呈阳性),在近50%的迟发性非胸腺瘤病例中也有检测到,而在早发性MG中非常罕见[18,19]。由于抗纹状抗体以细胞内抗原为靶点,它们的致病性尚不确定,但它们是有价值的标志物胸腺瘤,至少在年轻的MG患者中[20]有价值。
12%~15%的日本重症肌无力患者中报告了针对肌肉电压门控钾通道α亚单位的Kv1.4抗体,与胸腺瘤、重症肌无力和伴有心律失常的心肌炎相关[21,22]。有趣的是,这些发现在高加索患者中没有得到证实[23]。
胸腺瘤相关的MG被认为是由肿瘤性胸腺微环境相关的中枢耐受缺陷引起的。类似的机制可能在其他副肿瘤性疾病中运行。如前所述,在正常胸腺中,发育中的T淋巴细胞经历了连续的成熟阶段,从胸腺皮质中的CD4+CD8+双阳性(DP)细胞到髓质中的CD4+CD8-和CD4-CD8+单阳性(抑制性) T细胞。阳性和阴性选择过程确保(大部分)自我耐受的SP T细胞被释放到外周。基质细胞,如胸腺上皮细胞和树突状细胞对T淋巴细胞库的形成至关重要[24]。
胸腺瘤亚型的胸腺生成能力不同[22]。AB和B胸腺瘤能够支持胸腺细胞的发育,并含有大量的双阳性皮质T细胞。相反,胸腺瘤的胸腺生成功能很低,而胸腺癌几乎没有[16]。
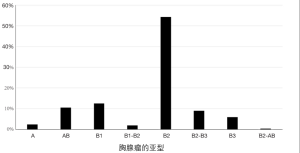
图2显示了我们人群中的胸腺瘤组织学亚型。当地病理学家对所有胸腺瘤标本进行了长期审查,并根据世界卫生组织系统进行了分类[4,5]。
B型胸腺瘤是最常见的亚型MG(见图2),肿瘤内T淋巴细胞成熟和成熟T细胞的输出似乎都是副肿瘤性 MG 发展的先决条件 [16]。尽管肿瘤性胸腺上皮细胞表达AChR单个表位亚基和肌联蛋白,但胸腺瘤组织中主要组织相容性复合物II类分子和AIRE基因的表达较低,这两者都是有效的胸腺细胞选择所必需的[17]。“皮质”B胸腺瘤(髓区稀疏)的髓功能缺陷可能是自身反应性CD4+ 抑制性T细胞输出和调节性T细胞产生减少的原因。这种失衡似乎是MG相关性胸腺瘤的一个显著特征[17]。
蛋白酪氨酸磷酸酶非受体22 (PTPN22)和细胞毒性T淋巴细胞相关抗原4 (CTLA-4)都是T淋巴细胞活化的抑制剂。据报道,这些基因的变异与不同的自身免疫性疾病有关,包括重症肌无力[25,26]。CTLA4+49A>G [27,28]和两种不同的PTPN22基因型[28,29]与MG和胸腺瘤相关。此外,MG胸腺瘤患者外周和瘤内T细胞比非MG胸腺瘤患者具有更高的抗凋亡因子细胞FLICE样抑制蛋白(c-FLIP)表达水平[30]。这些结果证实了活化的T细胞在胸腺瘤相关自身免疫性疾病的发病机制中的作用。
少数重症肌无力患者可能患有胸腺脂肪瘤,这是一种罕见的胸腺良性肿瘤,含有成熟的脂肪组织和胸腺残余物。在这些情况下,MG通常是抗AChR阳性,其严重程度和结果似乎与胸腺瘤相关疾病没有区别[31,32]。
兰伯特-伊顿肌无力综合征 (LEMS)
LEMS病是一种罕见的神经肌肉自主神经传导障碍,其中神经末梢的电压门控钙通道(VGCC)的异常显著减少乙酰胆碱的释放。这些患者主诉腿部近端肌肉普遍存在肌肉无力、腱反射丧失和自主神经紊乱[33]。副肿瘤性LEMS通常与小细胞肺癌有关[33],但与胸腺肿瘤的关联很少被报道[34,35]。在这些患者中,肿瘤治疗带来了显著的临床益处。
外周和中枢神经系统疾病
获得性神经肌肉强直(aNMT)和莫万综合征(MoS)是由于周围神经过度兴奋引起的特征性疾病。当出现副肿瘤时,这些情况通常与胸腺瘤有关。NMT是一种抗体介导的疾病,最早证据来自将疾病相关的电生理异常被动转移到具有患者IgG的小鼠上的研究。然后,自从识别出与电压门控钾通道抗体结合的自身抗体后,NMT和MoS被认为是自身免疫性通道疾病[36]。
这些抗体最初是通过放射免疫测定法检测到的,其中电压门控钾通道抗体从哺乳动物脑膜溶解并用碘化树眼镜蛇毒素标记,被患者的IgG沉淀。这些抗体被认为直接与α-树眼镜蛇毒素结合的电压门控钾通道亚基结合(Kv 1.1、1.2 和 1.6)。然而,最近有研究表明,患者血清IgG最常与富含亮氨酸的胶质瘤灭活蛋白1 (LGI1)和接触相关蛋白样2 (CASPR2)的胞外结构域结合,这两种蛋白与电压门控钾通道抗体复合[37,38]。事实上,CASPR2抗体更常见于胸腺瘤相关的NMT和MoS [39]患者中,而LGI1抗体通常在非副肿瘤性自身免疫性脑炎患者中发现[38]。此外,最近在NMT或胸腺瘤相关重症肌无力患者中发现了轴突生长诱向因子-1受体抗体(DCC和UNC5A)。在胸腺瘤样本和正常胸腺中都显示了DCC、UNC5A和Caspr2蛋白的表达[40]。轴突生长诱向因子-1受体抗体的致病作用尚未被研究。
获得性神经肌肉强直
aNMT的特征是由于持续的神经去极化而自发的肌肉活动。临床表现包括肌麻痹(弥漫性肌肉抽搐)、肌束震颤和痉挛;多汗症是常见的,长期患病的患者会发展成肌肉肥大[41]。肌电图显示自发的运动单位放电为双脉冲、三脉冲、多脉冲(肌动放电),以及不太常见的长脉冲,具有较高的脉冲内频率(神经肌肉强直放电)[42]。在高达20%的病例中,aNMT与中枢神经系统受累的迹象有关,如情绪变化和睡眠障碍。在胸腺瘤患者中,aNMT通常与MG相关。重要的是,aNMT的发作和恶化都预示着肿瘤复发[43]。
NMT症状通常通过钠通道阻滞剂如卡马西平、苯妥英或拉莫三嗪来改善。对于症状严重的患者,可能需要用皮质类固醇和硫唑嘌呤进行血浆置换和免疫抑制[44]。当与胸腺瘤相关时,肿瘤治疗可显著改善神经系统疾病。
莫万综合症
在莫万综合症患者中,NMT症与脑病、伴有长时间失眠的睡眠障碍(失眠)、自主神经功能障碍(多汗、括约肌功能障碍)和(或)疼痛有关。CASPR2抗体在这些患者中最常见,通常与LGI1抗体相关。胸腺瘤可在高达50%的CASPR2抗体患者中检测到,通常与MG有关[45]。
外周和中枢症状均对血浆置换和免疫抑制治疗有反应,并且可能通过胸腺瘤治疗进一步改善。
脑炎
副肿瘤性脑炎通常表现为与癫痫发作、情绪或行为障碍相关的亚急性(数天至数周)记忆障碍[46]。
一些患者在发病时会出现幻觉、妄想和奇怪的行为,最初可能会被转给精神病医生。在大多数情况下,癫痫发作和意识水平的改变都会随之而来。脑部核磁共振成像通常在T2加权图像上显示内侧颞叶的高信号病变,但也可能是阴性的。脑脊液分析可检测到蛋白质含量增加或中度淋巴细胞增多症,少数患者可显示寡克隆带的存在。胸腺瘤相关的自身免疫性脑炎通常与致病性自身抗体和膜神经抗原结合有关,通常对免疫治疗和抗肿瘤治疗有良好反应。细胞内抗原抗体的存在很少见。
对电压门控钾通道复合蛋白LGI1和CASPR2胞外区有特异性的血清IgG是胸腺相关脑炎患者中最常见的抗体。特别是,虽然LGI1抗体主要在非副肿瘤性脑炎中检测到,但胸腺瘤患者更多的是与CASPR2或LGI1和CASPR2结合的抗体(图3)。在最近对256名LGI1-IgG和(或)CASPR2-IgG患者进行的分析中,33%的LGI1和CASPR2-抗体患者、5%的孤立性CASPR2-患者和不到1%的孤立性LGI1抗体患者检测到胸腺瘤[47]。
在自身免疫性脑炎和胸腺瘤患者中检测到的与神经元膜蛋白结合的其他神经元自身抗体对氨甲基磷酸 (AMPAR)和γ-氨基丁酸(GABAAR)受体具有特异性。与AMPAR-IgG相关的脑炎通常表现为典型的边缘性脑炎,伴有记忆障碍、情绪改变和癫痫发作。在多达40%的AMPAR-IgG患者中,可以观察到弥漫性脑病,而少数患者可以发展为不同的综合征,如快速进展性痴呆或精神病。GABAAR-IgG患者通常会出现标准抗癫痫治疗难治的癫痫发作[48]。核磁共振可能在T2加权图像上显示多灶性皮质和近皮质高信号病变。大多数患者对免疫疗法有反应。大约30%GABAAR-抗体的成年患者中检测到胸腺瘤[49]。
与脑衰蛋白反应介质蛋白5结合的自身抗体,也称为CV2,是一种参与调节树突发育和突触可塑性的细胞内蛋白,可在胸腺瘤和脑炎患者中观察到。这些患者可能出现边缘性脑炎或舞蹈病,免疫治疗通常是有益的[50,51]。
炎性肌肉疾病
不同的自身免疫性肌肉疾病,如皮肌炎[52]、肉芽肿性肌炎[53]和多发性肌炎[54]已被报道与胸腺肿瘤相关,无论有无MG。所有这些疾病都表现为肌肉无力、肌痛、血清肌酶水平升高和磁共振成像异常高信号。心肌可能与心力衰竭和心律失常有关[54]。在这些情况下,已经提出了抗纹状抗体的作用 [21] 但由于缺乏系统研究,仍不确定。
与淋巴瘤相关的PND
PND是霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHLs)的罕见伴发疾病[55]。副肿瘤性小脑变性(PCD)是HL [56]患者中最常见的PND。PCD代表一种典型的PND,最常见于卵巢癌、乳腺癌和小细胞肺癌或HL患者中,而迄今为止只有少数PCD与NHL相关的病例被报道[57]。PCD患者通常会出现头晕和眩晕,并迅速发展为严重的共济失调、构音障碍、复视和眼球震颤。脑脊液检查可显示蛋白浓度增加或轻度细胞增多,磁共振研究最初是正常的,而在病程后期可观察到小脑萎缩。多达80%的患者[58]在诊断出HL之前就出现了PCD症状。在PCD和HL患者中检测到的最常见的自身抗体是与 Delta 和 Notch 样表皮生长因子相关受体 (DNER) 结合的Tr-IgG [59],这是一种在浦肯野细胞树突中高度表达的膜蛋白,对小脑的发育至关重要。
最初在两名PCD和HL患者中发现了代谢型谷氨酸受体1 (mGluR1)特异性IgG。迄今为止,已描述了16例mGluR1抗体患者,其中6例有血液系统恶性肿瘤史(HL,2例;NHL,1例;T细胞皮肤淋巴瘤,2例;急性淋巴细胞白血病,1例) [60-63]。
与纵隔生殖细胞肿瘤相关的副肿瘤性神经综合征
纵隔生殖细胞癌是罕见的和异质的。在法国进行的一项回顾性多中心研究中,为了确定原发性纵隔生殖细胞肿瘤的频率和预后,超过60%的患者检测到非精原细胞肿瘤(NSGT),其次是32%的精原细胞瘤,而胸部畸胎瘤代表了最罕见的癌症类型[64]。
迄今为止,很少有与抗体结合Ma2或NMDA受体(N-甲基-D-天冬氨酸受体,NMDAR)和纵隔生殖细胞肿瘤相关的副肿瘤性脑炎患者的报道。
抗Ma2抗体脑炎可能与精原细胞瘤或NSGT相关。Ma2-IgG患者通常会出现与间脑受累(例如高热、发作性睡病和不适当抗利尿综合征)或脑干功能障碍相关的边缘系统脑炎,而一些患者可能会出现脑干功能障碍的症状(例如,共济失调、复视、吞咽困难,构音障碍)[65]。
在患有胸部畸胎瘤的患者中,抗NMDAR脑炎(主要是男性)很少有报道。这种形式的自身免疫性脑炎具有特征性的临床特征。患者出现行为障碍,然后癫痫发作,通常标准的抗癫痫治疗无效,并出现运动障碍(口颊运动障碍和张力障碍姿势)[66]。在疾病过程中可能会出现昏迷、中枢性低通气和自主神经功能障碍,导致患者进入重症监护室,如果不进行适当的治疗,甚至可能导致患者死亡。目前尚无针对抗NMDAR脑炎患者的标准化治疗指南。血浆置换、静脉注射免疫球蛋白和大剂量静脉注射类固醇可改善神经功能缺损[67]。对一线治疗无反应的患者,利妥昔单抗或环磷酰胺可能是有效的治疗方法。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor Mirella Marino for the series “Diagnostic Problems in Anterior Mediastinum Lesions” published in Mediastinum. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/med.2018.01.03). The series “Diagnostic Problems in Anterior Mediastinum Lesions” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Duwe BV, Sterman DH, Musani AI. Tumors of the mediastinum. Chest 2005;128:2893-909. [Crossref] [PubMed]
- Hoftberger R, Rosenfeld MR, Dalmau J. Update on neurological paraneoplastic syndromes. Curr Opin Oncol 2015;27:489-95. [Crossref] [PubMed]
- Klein L, Kyewski B, Allen PM, et al. Positive and negative selection of the T cell repertoire: what thymocytes see (and don't see). Nat Rev Immunol 2014;14:377-91. [Crossref] [PubMed]
- Rosai J, Sobin LH, World Health Organization. Histological typing of tumours of the thymus. In: International histological classification of tumours. Berlin: Springer, 1999.
- WHO Classification of Tumors. Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart. Lyon: International Agency for Research on Cancer (IARC) Press, 2004.
- Marx A, Willcox N, Leite MI, et al. Thymoma and paraneoplastic myasthenia gravis. Autoimmunity 2010;43:413-27. [Crossref] [PubMed]
- Keesey JC. Clinical evaluation and management of myasthenia gravis. Muscle Nerve 2004;29:484-505. [Crossref] [PubMed]
- Gomez AM, Van Den Broeck J, Vrolix K, et al. Antibody effector mechanisms in myasthenia gravis-pathogenesis at the neuromuscular junction. Autoimmunity 2010;43:353-70. [Crossref] [PubMed]
- Marx A, Pfister F, Schalke B, et al. The different roles of the thymus in the pathogenesis of the various myasthenia gravis subtypes. Autoimmun Rev 2013;12:875-84. [Crossref] [PubMed]
- Gilhus NE. Myasthenia Gravis. N Engl J Med 2016;375:2570-81. [Crossref] [PubMed]
- Burden SJ, Yumoto N, Zhang W. The role of MuSK in synapse formation and neuromuscular disease. Cold Spring Harb Perspect Biol 2013;5:a009167 [Crossref] [PubMed]
- Yumoto N, Kim N, Burden SJ. Lrp4 is a retrograde signal for presynaptic differentiation at neuromuscular synapses. Nature 2012;489:438-42. [Crossref] [PubMed]
- Evoli A, Alboini PE, Bisonni A, et al. Management challenges in muscle-specific tyrosine kinase myasthenia gravis. Ann N Y Acad Sci 2012;1274:86-91. [Crossref] [PubMed]
- Marino M, Scuderi F, Samengo D, et al. Flow Cytofluorimetric Analysis of Anti-LRP4 (LDL Receptor-Related Protein 4) Autoantibodies in Italian Patients with Myasthenia Gravis. PLoS One 2015;10:e0135378 [Crossref] [PubMed]
- Maggi L, Andreetta F, Antozzi C, et al. Two cases of thymoma-associated myasthenia gravis without antibodies to the acetylcholine receptor. Neuromuscul Disord 2008;18:678-80. [Crossref] [PubMed]
- Okumura M, Fujii Y, Shiono H, et al. Immunological function of thymoma and pathogenesis of paraneoplastic myasthenia gravis. Gen Thorac Cardiovasc Surg 2008;56:143-50. [Crossref] [PubMed]
- Marx A, Porubsky S, Belharazem D, et al. Thymoma related myasthenia gravis in humans and potential animal models. Exp Neurol 2015;270:55-65. [Crossref] [PubMed]
- Skeie GO, Aarli JA, Gilhus NE. Titin and ryanodine receptor antibodies in myasthenia gravis. Acta Neurol Scand Suppl 2006;183:19-23. [Crossref] [PubMed]
- Meriggioli MN, Sanders DB. Muscle autoantibodies in myasthenia gravis: beyond diagnosis? Expert Rev Clin Immunol 2012;8:427-38. [Crossref] [PubMed]
- Choi Decroos E, Hobson-Webb LD, Juel VC, et al. Do acetylcholine receptor and striated muscle antibodies predict the presence of thymoma in patients with myasthenia gravis? Muscle Nerve 2014;49:30-4. [Crossref] [PubMed]
- Suzuki S, Utsugisawa K, Nagane Y, et al. Three types of striational antibodies in myasthenia gravis. Autoimmune Dis 2011;2011:740583
- Suzuki S, Nishimoto T, Kohno M, et al. Clinical and immunological predictors of prognosis for Japanese patients with thymoma-associated myasthenia gravis. J Neuroimmunol 2013;258:61-6. [Crossref] [PubMed]
- Romi F, Suzuki S, Suzuki N, et al. Anti-voltage-gated potassium channel Kv1.4 antibodies in myasthenia gravis. J Neurol 2012;259:1312-6. [Crossref] [PubMed]
- Klein L, Hinterberger M, Wirnsberger G, et al. Antigen presentation in the thymus for positive selection and central tolerance induction. Nat Rev Immunol 2009;9:833-44. [Crossref] [PubMed]
- Criswell LA, Pfeiffer KA, Lum RF, et al. Analysis of families in the multiple autoimmune disease genetics consortium (MADGC) collection: the PTPN22 620W allele associates with multiple autoimmune phenotypes. Am J Hum Genet 2005;76:561-71. [Crossref] [PubMed]
- Ueda H, Howson JM, Esposito L, et al. Association of the T-cell regulatory gene CTLA4 with susceptibility to autoimmune disease. Nature 2003;423:506-11. [Crossref] [PubMed]
- Chuang WY, Strobel P, Gold R, et al. A CTLA4high genotype is associated with myasthenia gravis in thymoma patients. Ann Neurol 2005;58:644-8. [Crossref] [PubMed]
- Zheng K, Zhang J, Zhang P, et al. PTPN22 and CTLA-4 gene polymorphisms in resected thymomas and thymus for myasthenia gravis. Thorac Cancer 2012;3:307-12. [Crossref] [PubMed]
- Chuang WY, Strobel P, Belharazem D, et al. The PTPN22gain-of-function+1858T(+) genotypes correlate with low IL-2 expression in thymomas and predispose to myasthenia gravis. Genes Immun 2009;10:667-72. [Crossref] [PubMed]
- Belharazem D, Schalke B, Gold R, et al. cFLIP overexpression in T cells in thymoma-associated myasthenia gravis. Ann Clin Transl Neurol 2015;2:894-905. [Crossref] [PubMed]
- Rieker RJ, Schirmacher P, Schnabel PA, et al. Thymolipoma. A report of nine cases, with emphasis on its association with myasthenia gravis. Surg Today 2010;40:132-6. [Crossref] [PubMed]
- Huang CS, Li WY, Lee PC, et al. Analysis of outcomes following surgical treatment of thymolipomatous myasthenia gravis: comparison with thymomatous and non-thymomatous myasthenia gravis. Interact Cardiovasc Thorac Surg 2014;18:475-81. [Crossref] [PubMed]
- Schoser B, Eymard B, Datt J, et al. Lambert-Eaton myasthenic syndrome (LEMS): a rare autoimmune presynaptic disorder often associated with cancer. J Neurol 2017;264:1854-63. [Crossref] [PubMed]
- Nalbantoglu M, Kose L, Uzun N, et al. Lambert-Eaton myasthenic syndrome associated with thymic neuroendocrine carcinoma. Muscle Nerve 2015;51:936-8. [Crossref] [PubMed]
- Morimoto M, Osaki T, Nagara Y, et al. Thymoma with Lambert-Eaton myasthenic syndrome. Ann Thorac Surg 2010;89:2001-3. [Crossref] [PubMed]
- Shillito P, Molenaar PC, Vincent A, et al. Acquired neuromyotonia: evidence for autoantibodies directed against K+ channels of peripheral nerves. Ann Neurol 1995;38:714-22. [Crossref] [PubMed]
- Irani SR, Alexander S, Waters P, et al. Antibodies to Kv1 potassium channel-complex proteins leucine-rich, glioma inactivated 1 protein and contactin-associated protein-2 in limbic encephalitis, Morvan's syndrome and acquired neuromyotonia. Brain 2010;133:2734-48. [Crossref] [PubMed]
- Lai M, Huijbers MG, Lancaster E, et al. Investigation of LGI1 as the antigen in limbic encephalitis previously attributed to potassium channels: a case series. Lancet Neurol 2010;9:776-85. [Crossref] [PubMed]
- Vincent A, Irani SR. Caspr2 antibodies in patients with thymomas. J Thorac Oncol 2010;5:S277-80. [Crossref] [PubMed]
- Torres-Vega E, Mancheno N, Cebrian-Silla A, et al. Netrin-1 receptor antibodies in thymoma-associated neuromyotonia with myasthenia gravis. Neurology 2017;88:1235-42. [Crossref] [PubMed]
- Isaacs H. A Syndrome of Continuous Muscle-Fibre Activity. J Neurol Neurosurg Psychiatry 1961;24:319-25. [Crossref] [PubMed]
- Gutmann L, Gutmann L. Myokymia and neuromyotonia 2004. J Neurol 2004;251:138-42. [Crossref] [PubMed]
- Fleisher J, Richie M, Price R, et al. Acquired neuromyotonia heralding recurrent thymoma in myasthenia gravis. JAMA Neurol 2013;70:1311-4. [PubMed]
- Skeie GO, Apostolski S, Evoli A, et al. Guidelines for treatment of autoimmune neuromuscular transmission disorders. Eur J Neurol 2010;17:893-902. [Crossref] [PubMed]
- Irani SR, Pettingill P, Kleopa KA, et al. Morvan syndrome: clinical and serological observations in 29 cases. Ann Neurol 2012;72:241-55. [Crossref] [PubMed]
- Iorio R, Lennon VA. Neural antigen-specific autoimmune disorders. Immunol Rev 2012;248:104-21. [Crossref] [PubMed]
- Gadoth A, Pittock SJ, Dubey D, et al. Expanded phenotypes and outcomes among 256 LGI1/CASPR2-IgG-positive patients. Ann Neurol 2017;82:79-92. [Crossref] [PubMed]
- Petit-Pedrol M, Armangue T, Peng X, et al. Encephalitis with refractory seizures, status epilepticus, and antibodies to the GABAA receptor: a case series, characterisation of the antigen, and analysis of the effects of antibodies. Lancet Neurol 2014;13:276-86. [Crossref] [PubMed]
- Spatola M, Petit-Pedrol M, Simabukuro MM, et al. Investigations in GABAA receptor antibody-associated encephalitis. Neurology 2017;88:1012-20. [Crossref] [PubMed]
- Honnorat J, Cartalat-Carel S, Ricard D, et al. Onco-neural antibodies and tumour type determine survival and neurological symptoms in paraneoplastic neurological syndromes with Hu or CV2/CRMP5 antibodies. J Neurol Neurosurg Psychiatry 2009;80:412-6. [Crossref] [PubMed]
- Yu Z, Kryzer TJ, Griesmann GE, et al. CRMP-5 neuronal autoantibody: marker of lung cancer and thymoma-related autoimmunity. Ann Neurol 2001;49:146-54. [Crossref] [PubMed]
- Dell'Amore A, Asadi N, Caroli G, et al. Paraneoplastic dermatomyositis as presentation of thymic carcinoma. Gen Thorac Cardiovasc Surg 2013;61:422-5. [Crossref] [PubMed]
- Stefanou MI, Komorowski L, Kade S, et al. A case of late-onset, thymoma-associated myasthenia gravis with ryanodine receptor and titin antibodies and concomitant granulomatous myositis. BMC Neurol 2016;16:172. [Crossref] [PubMed]
- Kon T, Mori F, Tanji K, et al. Giant cell polymyositis and myocarditis associated with myasthenia gravis and thymoma. Neuropathology 2013;33:281-7. [Crossref] [PubMed]
- Graus F, Arino H, Dalmau J. Paraneoplastic neurological syndromes in Hodgkin and non-Hodgkin lymphomas. Blood 2014;123:3230-8. [Crossref] [PubMed]
- Briani C, Vitaliani R, Grisold W, et al. Spectrum of paraneoplastic disease associated with lymphoma. Neurology 2011;76:705-10. [Crossref] [PubMed]
- Iorio R, Sillevis Smitt P. Paraneoplastic Cerebellar Degeneration. In: Gruol DL, Koibuchi N, Manto M, et al., editor. Essentials of Cerebellum and Cerebellar Disorders. Springer, 2016.
- Bernal F, Shams'ili S, Rojas I, et al. Anti-Tr antibodies as markers of paraneoplastic cerebellar degeneration and Hodgkin's disease. Neurology 2003;60:230-4. [Crossref] [PubMed]
- de Graaff E, Maat P, Hulsenboom E, et al. Identification of delta/notch-like epidermal growth factor-related receptor as the Tr antigen in paraneoplastic cerebellar degeneration. Ann Neurol 2012;71:815-24. [Crossref] [PubMed]
- Iorio R, Damato V, Mirabella M, et al. Cerebellar degeneration associated with mGluR1 autoantibodies as a paraneoplastic manifestation of prostate adenocarcinoma. J Neuroimmunol 2013;263:155-8. [Crossref] [PubMed]
- Lopez-Chiriboga AS, Komorowski L, Kumpfel T, et al. Metabotropic glutamate receptor type 1 autoimmunity: Clinical features and treatment outcomes. Neurology 2016;86:1009-13. [Crossref] [PubMed]
- Marignier R, Chenevier F, Rogemond V, et al. Metabotropic glutamate receptor type 1 autoantibody-associated cerebellitis: a primary autoimmune disease? Arch Neurol 2010;67:627-30. [Crossref] [PubMed]
- Lancaster E, Martinez-Hernandez E, Titulaer MJ, et al. Antibodies to metabotropic glutamate receptor 5 in the Ophelia syndrome. Neurology 2011;77:1698-701. [Crossref] [PubMed]
- Rivera C, Arame A, Jougon J, et al. Prognostic factors in patients with primary mediastinal germ cell tumors, a surgical multicenter retrospective study. Interact Cardiovasc Thorac Surg 2010;11:585-9. [Crossref] [PubMed]
- Dalmau J, Graus F, Villarejo A, et al. Clinical analysis of anti-Ma2-associated encephalitis. Brain 2004;127:1831-44. [Crossref] [PubMed]
- Dalmau J, Lancaster E, Martinez-Hernandez E, et al. Clinical experience and laboratory investigations in patients with anti-NMDAR encephalitis. Lancet Neurol 2011;10:63-74. [Crossref] [PubMed]
- Titulaer MJ, McCracken L, Gabilondo I, et al. Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study. Lancet Neurol 2013;12:157-65. [Crossref] [PubMed]

程磊
成都大学附属医院胸心外科医师,德国基尔大学博士在读,以往主要参与了3项省市级课题项目:卫生部项目(W2012FZ061):分子诊断技术在肺癌个体化治疗中的应用研究;四川省卫生厅(120577),乌司他丁对胸部撞击伤后急性肺损伤抗炎因子变化的研究;成都市卫计委课题(2018061),聚乳酸肋骨钉与纯钛环抱器在活体组织内生物学特性的对照研究。发表论文3篇。(更新时间:2021/8/13)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Iorio R, Spagni G, Evoli A. Paraneoplastic neurological syndromes associated with mediastinal tumors. Mediastinum 2018;2:8.