
胸腺瘤和胸腺癌:解读NCCN肿瘤学临床实践指南
简介
尽管近年来人们对胸腺肿瘤(即胸腺瘤和胸腺癌)的发生、诊断、分期和命名给予了极大关注。然而,现实情况是,胸腺肿瘤作为一类尚未被深入认识的肿瘤,不仅容易被误诊为其他肿瘤(如:霍奇金淋巴瘤误诊为肉芽肿性胸腺瘤或精原细胞瘤误诊为精原细胞性胸腺瘤),而且最近还采用了相当不科学的命名方法(如使用字母和数字进行命名)。在命名和分期的问题上,这两种不同类型的肿瘤被错误地使用了相同的方案。我们可以很容易地发现人们对胸腺肿瘤(胸腺瘤和胸腺癌)相关领域仍知之甚少。以下原因导致了这种对胸腺瘤和胸腺癌的认识模糊不清的状况:(I) 这些肿瘤的发病率低; (II) 这些肿瘤一直以来缺乏足够深度的认识; (III) 把胸腺瘤和胸腺癌归为一类的错误分类方案; (IV) 提出的命名方法更多的带有政治色彩而不是遵循科学方法; (V)提出的分期系统更像是 "虚拟方案",即只是基于理论而不是实际情况;(VI)缺乏一个 "真正的 "专家小组,能够针对这个领域提出一些有意义、不包含个人因素的科学性提议。
目前NCCN指南的服务对象似乎主要是为一线治疗的医生而不是病理医生。如果真是这样定位, 那么为什么指南中还包括诊断标准和(或)对于肿瘤的组织学分类的命名。简而言之,当涉及到对胸腺瘤和胸腺癌的理解和认识时,这些指南是当前病理学和肿瘤学之间脱节的反映。严格来说,NCCN指南的胸腺瘤病理诊断标准可能只是适合于医学生,而不是有经验的外科病理医生,更不用说有经验的胸腔领域亚专科的病理医生了。简单罗列出强制性和选择性标准并不合理,例如,肿瘤科医生或外科医生是否会仅仅因为病理科医生没有对TdT进行免疫组化染色去显示未成熟淋巴细胞,而不接受胸腺瘤的诊断?人们可以列举出更多关于这些强制性和选择性标准的问题,因为这些标准似乎是由那些对胸腺瘤缺乏认识的人员所撰写的。
命名和分期
Bernatz于1961年提出[1],胸腺瘤的命名基本上是完全错误的。Bernatz等人[1,2]根据淋巴细胞的比例,并在一定程度上根据上皮细胞的形态,提出了一个简单而可行的分类方案。即上皮细胞丰富的胸腺瘤、淋巴细胞丰富的胸腺瘤或梭形细胞胸腺瘤。这个分类系统中需要强调的是:
- 它是基于手术切除样本制定的;
- 基于100多个病例总结而来;
- 更重要的是,该组织学分类方案并不试图根据组织学来预测预后,而是强调肿瘤侵袭性是影响临床结果的最重要因素。
目前许多人可能忽略了,这种分类方法实际上是对其他报告强调胸腺瘤异质性的呼应[3]。Bernatz分类系统[1,2]即使在今天也能够在大多数情况下经受住可重复性的考验。
1985年,Marino和Muller-Hermelink[4]发表了一项基于58例胸腺瘤和13例胸腺癌的研究,并提出了所谓的组织遗传学分类方案:皮质型、髓质型和混合型胸腺瘤。该方案需要强调的重要问题:
- 是针对活检标本提出的建议;
- 研究表明,髓质胸腺瘤的起源细胞是胸腺的髓质上皮细胞,而皮质胸腺瘤则来自胸腺皮质的上皮细胞;
- 该方案指出,病理组织学对预后有预测作用;
- 只有三个活检样本归属于髓质胸腺瘤(梭形细胞胸腺瘤),而正是基于这三个样本使得这是个病例是良性肿瘤的说法得以成立。
毋庸置疑,这样的分类方案在现代外科病理学中是史无前例的。这个理论体系的大部分内容甚至还没有被该方案的提出者证明出来[5,6],并且有一些假设后来也被证明是错误的[7,8]。
当世界卫生组织(WHO)参与这场争论时,问题已经解决,该组织的成员在1999年[9]基本上只参考了下列两种方案:1961年的Bernatz分类和1985年的Marino-Muller-Hermelink分类。结果,推出了一个涵盖了上述两种分类系统、结合字母和数字的“折中表述形式”,并于1999年[9]声明这些字母和数字并不代表一个具体的分类系统,但这个细节却被后来2004年和2015年发表的两份WHO出版物的编写者们忽略了。
与Bernatz、Marino-Muller-Hermelink以及WHO观点不同, 我们仍然认为WHO的 A型、B1型和B2型胸腺瘤虽然在病理组织学上存在差异,但却有具有相似的临床生物学行为。这使得这种分类的实用价值不高,这一点也被其他人在较大的病例样本研究中所证实。我们认为最重要的是将 "不典型胸腺瘤"(WHO B3型)区分开,虽然该类型肿瘤比其他组织类型胸腺瘤发病率更低,但大多数肿瘤在被诊断时已经是浸润性状态,因此具有更强的侵袭性[10-14]。由此便形成了胸腺瘤-不典型胸腺瘤-胸腺癌的概念。
关于胸腺瘤的分期,目前有两种方案,即便只是描述肿瘤的解剖分布,这两种分期方案也都能提供有意义的临床结果[15-17]。然而,两者也有一些重要的区别。经Koga修改的Masaoka分期方案中的I期和II 期患者具有相似的生存率,这在比较这些分期方案的Meta分析研究中已被证实[18]。相反,Moran分期方案强调区别侵袭性胸腺瘤(II和III期)和局限性胸腺瘤(0期和I期)的重要性。更重要的是,它提出了0期相当于原位肿瘤这个问题。这个分期方案的价值最近在应用该分期方案的1470例胸腺瘤手术切除病例研究中得到了验证[14]。
关于胸腺癌,病理学界并不感到疑惑,因为病理医生能够明确地将胸腺瘤与胸腺癌及其不同的变体清楚地区分开来。然而,在以前为胸腺瘤提出的方案中,诸如 "恶性胸腺瘤 "这样的名称被等同于胸腺癌,时至今日,仍然有许多人这样使用这一名称,以致于在这些肿瘤的正确命名上问题不断。所以对此现象,作出以下明确声明是非常重要的:1)无论恶性胸腺瘤的具体概念是什么,都不意味着是胸腺癌。2)很可能 "恶性胸腺瘤 "的概念是等同于 " 侵袭性胸腺瘤 "这一概念。此外,需要强调的是,大多数胸腺癌都是鳞癌,这真正体现了临床和影像学的相关性。胸腺癌从病理学上讲没有任何特征,其诊断需要纵隔肿物的影像学证据[19,20]。与Masaoka分期系统适用于胸腺瘤不同,胸腺癌通常涉及淋巴结转移,所以使用Masaoka分期系统其实是不合适的。实际上,对于胸腺癌来说,TNM分期更有价值,而且该分期方案也已在相关文献中提出[21],但今天仍有部分已发表的大量关于胸腺瘤和胸腺癌文献的学者忽略这一点,他们认为这两种肿瘤是一样的。目前已证明,在胸腺癌中淋巴结转移会改变患者的生存率[21]。
基于这一背景,现在NCCN制定了胸腺瘤和胸腺癌的临床指南[22]。接下来让我们更细致地探讨该指南在胸腺瘤和胸腺癌研究中的地位:
- 作者将R0切除无包膜侵犯的胸腺瘤及I期(可能使用Masaoka的分期)的胸腺癌归为一组。这两种肿瘤即使未突破包膜,也很可能具备不一样的临床生物学行为。局限在包膜内的胸腺瘤可以通过完全的手术切除被治愈,但对于胸腺癌来说,情况并非如此。包膜的完整性对胸腺瘤是有意义的,然而区别于边界清晰的胸腺瘤,胸腺癌通常都表现为边界不规则的肿块,所以胸腺癌并不一定具有完整的包膜。然而,这种分组显然证明了将胸腺瘤和胸腺癌等同看待的错误概念。此外,作者所描述的胸腺癌类型尚不清楚。是腺癌?神经内分泌癌?无性细胞癌?梭形细胞癌,还是鳞癌?
- 同样还是R0的病例,作者把有包膜侵犯的胸腺瘤或胸腺癌一同归为II- IV期,而这个问题更令人担忧。众所周知,微浸润的胸腺瘤的生物学行为与无包膜侵犯的胸腺瘤相似[14]。然而,同样侵袭程度的胸腺癌会导致不同的临床结局。毋庸置疑,晚期胸腺癌或胸腺瘤尽管进行了完全的手术切除,其临床结果也是不同的。
- 作者参考WHO指南得到了胸腺瘤的诊断特征,而该指南多次被证实实用性不够。但更有趣的是,NCCN指南的作者和WHO指南的编者一样,将一个其他的分类系统与WHO的分期方案混为一体。非典型胸腺瘤是Suster-Moran在他们的胸腺瘤分类方案中所提出的一个概念。非典型胸腺瘤并不是WHO所提出的概念,WHO分类方案使用的是字母和数字,并且默认了通过组织学预测预后的理念。因此非典型A型胸腺瘤的概念虽然可被理解,但完全没有实际意义,除非你使用的是Suster-Moran分类方案。此外,作者还制定了包括强制性标准和理想标准。在强制性标准中,包括使用免疫组化染色。但对于有经验的胸腺瘤病理科医生来说,完全不需要使用这种辅助手段。此外,在理想标准中,还包括发现Hassall's 小体和血管周围间隙。这不是病理医生进行病理诊断的方式,病理医生是根据肿瘤的整体生物学方案和细节表现来做出诊断。这些指南的适用对象,可能是非病理学医生或医学生的。因为如果这些指南是为执业病理科医生制定的,那么相关内容及细节略显模糊;但如果是为有经验的纵隔领域的病理科医生制定,这些指南则是完全错误的。
- 作者提出了微结节型胸腺瘤概念(MNT)。对于有经验的病理科医生来说,这类肿瘤在纵隔肿瘤中代表了一种容易被识别且恰好又有B淋巴细胞增生的生长方式[23]。识别这类肿瘤的重要性在于,它曾被误诊为淋巴结转移性胸腺瘤。此外,这种生长方式还有一个变异型,即小结节性胸腺癌[24]。再一次强调,这类肿瘤的形态很典型,足以在形态学基础上进行诊断。
- 作者将胸腺瘤的另一个亚型列为化生型胸腺瘤,这种重命名只是改变肿瘤的名称而已。这类肿瘤最初始的描述是"具有假肉瘤基质的胸腺瘤"[25]。后来,被错误地命名为化生型癌[26]。也许NCCN的作者和WHO的作者一样,即使有一个概念是错误的(化生型癌),但使用“化生”这个令人心动的名字也可以使得整体变得正确。
- 罕见的其他胸腺疾病-根据我们的经验,这些 "罕见的其他胸腺疾病 "在被误诊病例中占比较大。在这方面,NCCN指南的作者们应该提出强制性的诊断标准。因为正确的诊断对患者的预后有很大的影响。NCCN的作者完全忽略了诊断胸腺瘤最重要的部分,但也可能这些NCCN指南的作者本来就不具备诊断罕见胸腺瘤的必备经验。
- 作者引用了Masaoka的分期系统。然而,这里引用的并不是Masaoka或Koga的原意。也许作者打算对Masaoka分期系统进行解读或理想化。原始的Masaoka分期是用罗马数字和阿拉伯数字表述,因此I期又被分为1和2。而Koga对Masaoka的修改只是在一个部分,就是把II-2期的显微镜下侵犯包膜改成了穿透包膜。但这里有一个更大的问题,这一问题原本在Moran分期系统中已经得到了解决,NCCN的作者却没有解决[14,17]。这是一个可能语义学上的问题:在Masaoka 分期系统中,II-1期指显微镜下侵犯周围脂肪组织或纵隔胸膜,IVa期指胸膜或心包播散。众所周知,在最初诊断胸腺瘤时,肿瘤可能会侵犯胸膜,但不会出现胸膜播散。胸膜或心包播散多见于胸腺瘤的复发,但在最初诊断时并不常见。然而,在Masaoka方案中,只根据一个词—侵犯或播散,一个患者可以很容易地从II-1期转到IVa期。NCCN指南的作者有再次进行修正的机会,但他们选择了维持现状。也许是因为现在他们认可的是TNM分期,但有趣的是它借用了与Masaoka和Moran分类方案类似的定义。
- 作者新创建的TNM分期系统是基于理想状态而不是真实数据,并且没有一组病例是使用这种TNM分期系统。然而,人们可能会说,这个TNM系统由于借用了Masaoka和Moran方案的定义,那么可能就不需要有相应的案例支持。另一方面,人们也可以说,如果不需要案例支持,那么也许TNM系统的存在也是不需要的,因为其他方案在大多数情况下运作良好。我们知道,胸腺瘤很少转移到淋巴结。这一点NCCN指南的作者也承认。根据我们的经验,绝大多数情况下,从浸润性胸腺瘤中获得的肿瘤结节被误认为可能是淋巴结,但它并不是淋巴结,只是一个浸润性肿瘤结节。事实上,在迄今为止最大的胸腺瘤病例组中,我们收集了1470例胸腺瘤切除术的病例,没有一例淋巴结转移的案例。因此,即使TNM分期方案在肿瘤病理学上具有统一性,但它并不适用于胸腺瘤。此外,为了统一性,这个TNM分期方案包括TX,即原发肿瘤不能被评估。
- 这个系统的N分期和M分期已经在不同的稿件中多次讨论过,主要强调在胸腺癌中的重要性, 但对胸腺瘤鲜有价值。一旦胸腺癌转移到淋巴结,无论是哪个部位的淋巴结,都对生存期产生不同程度的影响。
- 作者将M1定义为胸膜、心包或远处的转移。作者所说的远处转移是什么意思?他们是指膈肌以下还是胸廓入口以上?(再一次声明,作者可以通过阅读Moran分期系统让自己做的更好)。作者是否认为胸膜转移的M1期病例等同于肾转移的病例?很明显,作者将这两种可能性都归入M1,就是暗示了这一点。在绝大多数病例中,胸腺瘤诊断时不会出现M1a和M1b期。胸腺瘤的侵袭特点是连续性并沿着正常结构生长的。一般只有当肿瘤复发时,人们才会观察到邻近结构中的独立结节。如此看来远处转移M的定义是来自于传统的肿瘤病理学,而不是基于胸腺瘤实际生长情况和生物学行为。
如果不能被评估,那么它可能不是胸腺瘤,因此这样的评估完全没有意义。另外,T0-没有原发肿瘤的证据--它在治疗前或治疗后分别意味着什么? Moran分期系统中T0的实际含义是指包膜内的胸腺瘤,即原位肿瘤。需要再次强调,这个TNM系统对其他类型的恶性肿瘤可能会非常实用,但对于胸腺瘤并不实用。T2 -肿瘤直接侵犯心包,无论是部分累及还是全层侵犯。那么作者所说的部分和全层具体是什么意思?他们对心包侵犯的标准是什么? 作者认为心包侵犯的起点是哪里?为了清楚起见,心包是一个有两个面的膜,一个是纵隔面,另一个是心脏面。也许作者需要回顾一下Moran分期系统,其中对心包侵犯有明确的定义。
表1展示了运用现有的不同分期方案对胸腺瘤的不同阶段进行描述。仔细观察这个AJCC分期方案,可以清楚地看到,它是对Masaoka分期方案和Moran分期方案进行了粗略改编。这个分期方案有以下几个缺点。在诊断为胸腺瘤时,基本上不会出现N转移和M转移,因此分期将主要聚焦于T分期。而关于T分期,完全没有提到胸腺瘤经常出现的所谓的种植播散转移。关于心包侵犯(T2)的定义是含糊不清的。在T3和T4中关于侵犯的大血管, 无论是主动脉(T4)还是上腔静脉(T3),对病理分期来说都没有特别意义。目前已经证明,一旦肿瘤侵犯大血管,就会影响生存。AJCC分期方案的这一调整是对于局限性病变和浸润性病变的预后缺乏预见性,这影响了治疗方案的选择。据分析,Moran分期方案中的0期和I期与生存率有很好的相关性,这些患者可能从完整手术切除中获益,而那些有浸润性疾病的患者可能需要额外的治疗措施。因此,对需要额外治疗的患者进行筛选,应该是所有分期方案的目标方向,而不仅仅是采用无差异化的处理。但更可怕的是这个分期方案在胸腺癌中的应用。例如,根据这个AJCC分期方案,作者认为III A期或III B期胸腺瘤的临床结局与同阶段的胸腺癌相似,这很显然是不正确的,而且,试图通过对胸腺瘤和胸腺癌进行相同的分期来形成 "统一",把这两种肿瘤混为一谈,绝对不是梳理并阐述清楚概念的方法。此外,胸腺癌的问题比指南中所说的更复杂,例如,胸腺癌可以是鳞状癌、腺癌,或者是未分化癌。这些肿瘤无论是否局限于纵隔,都具备较强的侵袭性[27]。毫无疑问,那些AJCC分期方案的编撰者并没有考虑到上述的诸多情况。
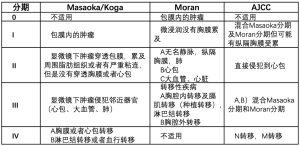
Full table
评论
与其它关于胸腺瘤和胸腺癌的出版物一样,NCCN 新出版的这个指南基本上维持了以前的错误理念,对加深胸腺瘤或胸腺癌的理解没有任何帮助。他们应该在诊断胸腺癌甚至是少见的胸腺瘤亚型方面制定严格的临床指南。然而,NCCN编撰者们却错失了这个机会,因为他们的工作重点只是为了提供一个关于胸腺瘤的强制性和理想诊断标准的表格,而这恰恰正是他们最不应该去努力的地方。WHO的胸腺瘤指南的制定已经被证明意义有限。由Bernatz 、Marino-Muller-Hermelink和Suster-Moran提出的分期方案,其优势在于他们是基于实际病例回顾所提出的真实建议,而不是凭空产生的,也不是为了满足个人或政治层面的目的。而引入TNM分期方案对胸腺瘤进行分期,并在没有确凿数据支持的情况下将同一分期的胸腺瘤与胸腺癌混为一谈,是非常不恰当的。尽管如此,对于那些将要使用这个TNM分期方案的人们,重要的是要理解T分期基本上是 "借用 "了Masaoka和Moran的分期方案。使用Masaoka或Moran的方案对胸腺瘤进行分期,是基于实际的病例,而不是凭空杜撰的。试图将一个或两个分期方案改编为一的TNM分期方案是不正确的。上述情况让我们回到了最初的结论,那就是除非有一个真正的专家组来阐明并带领大家梳理清楚该类疾病,否则胸腺瘤的问题将继续困扰着大家。指南是重要的,只要它们的观点有大量的病例及数据支持,并且应用于相关肿瘤具有良好的一致性。否则,重复相同的错误概念,看起来很科学,但并不能得到正确的结果。人们期望任何类型的指南在分析当前问题时更为严谨,而不是仅仅重复已经提到过的东西或改编一些没有数据支持的内容。
Acknowledgments
Funding: None.
Footnote
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/med .2018.07.05). CAM serves as an unpaid editorial board member of Mediastinum from Feb 2018 to Jan 2020. The other author has no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Bernatz PE, Harrison EG, Clagett OT. Thymoma: a clinicopathologic study. J Thorac Cardiovasc Surg 1961;42:424-44. [PubMed]
- Bernatz PE, Khonsari S, Harrison EG Jr, et al. Thymoma: factors influencing prognosis. Surg Clin North Am 1973;53:885-92. [Crossref] [PubMed]
- Salyer WR, Eggleston JC. Thymoma: a clinical and pathological study of 65 cases. Cancer 1976;37:229-49. [Crossref] [PubMed]
- Marino M, Müller-Hermelink HK. Thymoma and thymic carcinoma. Relation of thymoma epithelial cells to the cortical and medullary differentiation of thymus. Virchows Arch A Pathol Anat Histopathol 1985;407:119-49. [Crossref] [PubMed]
- Kirchner T, Schalke B, Buchwald J, et al. Well-differentiated thymic carcinoma. An organotypical low-grade carcinoma with relationship to cortical thymoma. Am J Surg Pathol 1992;16:1153-69. [Crossref] [PubMed]
- Kirchner T, Muller-Hermelin HK. New approaches to the diagnosis of thymic epithelial tumors. Prog Surg Pathol 1989;10:167-89. [Crossref]
- Moran CA, Kalhor N, Suster S. Invasive spindle cell thymomas (WHO Type A): a clinicopathologic correlation of 41 cases. Am J Clin Pathol 2010;134:793-8. [Crossref] [PubMed]
- Moran CA, Suster S. On the histologic heterogeneity of thymic epithelial neoplasms. Impact of sampling in subtyping and classification of thymomas. Am J Clin Pathol 2000;114:760-6. [Crossref] [PubMed]
- World Health Organization Ingternational Histological Classification of Tumours. Histological Typing of Tumours of the Thymus. Rosai J. In collaboration with L. H. Sobin and Pathologists in 8 countries. 2nd Edition. Berlin Heidelberg: Springer-Verlag 1999.
- Suster S, Moran CA. Thymoma, atypical thymoma, and thymic carcinoma. A novel conceptual approach to the classification of thymic epithelial neoplasms. Am J Clin Pathol 1999;111:826-33. [Crossref] [PubMed]
- Chalabreysse L, Etienne-Mastroianni B, Adeleine P, et al. Thymic carcinoma: a clinicopathological and immunohistological study of 19 cases. Histopathology 2004;44:367-74. [Crossref] [PubMed]
- Rieker RJ, Hoegel J, Morresi-Hauf A, et al. Histologic classification of thymic epithelial tumors: comparison of established classification schemes. Int J Cancer 2002;98:900-6. [Crossref] [PubMed]
- Moran CA, Weissferdt A, Kalhor N, et al. Thymomas I: a clinicopathologic correlation of 250 cases with emphasis on the World Health Organization schema. Am J Clin Pathol 2012;137:444-50. [Crossref] [PubMed]
- Weissferdt A, Kalhor N, Bishop JA, et al. Thymoma: a clinicopathological correlation of 1470 cases. Hum Pathol 2018;73:7-15. [Crossref] [PubMed]
- Masaoka A, Monden Y, Nakahara K, et al. Follow-up study of thymomas with special reference to their clinical stages. Cancer 1981;48:2485-92. [Crossref] [PubMed]
- Koga K, Matsuno Y, Noguchi M, et al. A review of 79 thymomas: modification of staging system and reappraisal of conventional division into invasive and non-invasive thymoma. Pathol Int 1994;44:359-67. [Crossref] [PubMed]
- Moran CA, Walsh G, Suster S, et al. Thymomas II: a clinicopathologic correlation of 250 cases with a proposed staging system with emphasis on pathologic assessment. Am J Clin Pathol 2012;137:451-61. [Crossref] [PubMed]
- Moran CA, Suster S. Thymic carcinoma: current concepts and histologic features. Hematol Oncol Clin North Am 2008;22:393-407. [Crossref] [PubMed]
- Gupta R, Marchevsky AM, McKenna RJ, et al. Evidence-based pathology and the pathologic evaluation of thymomas: transcapsular invasion is not a significant prognostic feature. Arch Pathol Lab Med 2008;132:926-30. [PubMed]
- Weissferdt A, Moran CA. Thymic carcinoma, part 1: a clinicopathologic and immunohistochemical study of 65 cases. Am J Clin Pathol 2012;138:103-14. [Crossref] [PubMed]
- Weissferdt A, Moran CA. Thymic carcinoma, part 2: a clinicopathologic correlation of 33 cases with a proposed staging system. Am J Clin Pathol 2012;138:115-21. [Crossref] [PubMed]
- National Comprehensive Cancer network. NCCN clinical practice guidelines in oncology (NCCN guidelines) Thymoma and Thymic carcinoma, version 2. 2018. Available online: https://www.nccn.org/professionals/physician_gls/default.aspx
- Suster S, Moran CA. Micronodular thymoma with lymphoid B-cell hyperplasia: clinicopathologic and immunohistochemical study of eighteen cases of a distinctive morphologic variant of thymic epithelial neoplasm. Am J Surg Pathol 1999;23:955-62. [Crossref] [PubMed]
- Weissferdt A, Moran CA. Micronodular thymic carcinoma with lymphoid hyperplasia: a clinicopathological and immunohistochemical study of five cases. Mod Pathol 2012;25:993-9. [Crossref] [PubMed]
- Suster S, Moran CA, Chan JK. Thymoma with pseudosarcomatous stroma: report of an unusual histologic variant of thymic epithelial neoplasm that may simulate carcinosarcoma. Am J Surg Pathol 1997;21:1316-23. [Crossref] [PubMed]
- Yoneda S, Marx A, Heimann S, et al. Low-grade metaplastic carcinoma of the thymus. Histopathology 1999;35:19-30. [Crossref] [PubMed]
- Kalhor N, Moran CA. Primary thymic adenocarcinomas: a clinicopathological and immunohistochemical study of 16 cases with emphasis on the morphological spectrum of differentiation. Hum Pathol 2018;74:73-82. [Crossref] [PubMed]

孙志勇
2005年至2008年:上海第二医科大学附属仁济医院外科住院医师,轮转普外科、肝移植科、麻醉科、外科重症监护、泌尿外科、骨科等科室,熟练掌握大外科常见疾病的诊断及治疗。2008年-至今在仁济医院胸外科工作。2018年在美国综合排名第一位的Mayo Clinic 研习胸外科微创手术及复杂食管外科手术及贲门失弛缓及GRED的外科治疗。2019年至上海肺科医院内镜中心研习支气管镜下的肺部肿瘤疾病诊断及腔道治疗。 先后在国内外核心期刊发表学术专业论文十余篇。长期参与医学院五年制及八年制临床带教工作,曾被评为“仁济医学院优秀带教老师”称号。由其组织策划的“胸外科学”入选交通大学医学院精品课程库。(更新时间:2021/8/24)

戴顺东
医学博士,毕业于中国医科大学病理学与病理生理学专业,师从王恩华教授(前中华医学会病理学分会副主任委员、中华医学会病理学分会胸部疾病学组组长)。现为上海交通大学医学院附属第九人民医院病理科行政副主任,副主任医师。曾主持2项国家自然科学基金、1项高等学校博士学科点专项科研基金联合资助课题、1项上海交通大学“新型冠状病毒防治”专项软课题、1项辽宁省自然科学基金项目(优秀人才培育项目)、1项国家级大学生创新创业训练计划,参与国家自然科学基金3项。2019年获得全国高校(医学类)微课教学比赛 二等奖。现为中华医学会病理学分会胸部疾病学组委员、中国老年医学学会病理分会胸部疾病学组委员、中国医药教育协会肺部肿瘤专委会病理学组会员、卫健委住院医师规范化培训结业考核题库建设专家、教育部学位中心评审专家。(更新时间:2021/8/24)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Kalhor N, Moran CA. Thymoma and thymic carcinoma: a perspective on the NCCN clinical practice guidelines in oncology. Mediastinum 2018;2:49.


