
超声内镜或电视辅助纵隔镜在PET-CT显示N1阳性非小细胞肺癌纵隔淋巴结分期中的应用
前言
伴有肺门淋巴结肿大的非小细胞肺癌患者,或者肺门、肺内淋巴结FDG摄取阳性(临床分期N1)的患者,手术切除时出现术前未知的纵隔淋巴结阳性(N2疾病)的风险约为20% ~30%[1-4]。
目前指南推荐对临床N1阳性的患者进行术前有创纵隔淋巴结分期,即电视辅助纵隔镜检查(VAM)或超声内镜检查[5,6],但是没有建议两种技术中哪一种更可取。此外,超声内镜检查阴性后再进行纵隔镜检查确认的建议也存在争议。反对确认纵隔镜检查的论点是基于N1阳性患者发生N2阳性的概率不到10%的研究,大多数只是影像学上的临床N2阳性[7,8]。
上述两项多中心前瞻性研究,报道了在N1阳性患者中超声内镜检查和纵隔镜检查的敏感性、阴性预测值(NPV)和准确性[9,10]。
研究方法
以上两项研究都是由研究者发起的非随机多中心前瞻性观察队列研究,在第一项研究中进行了超声内镜检查,在第二项研究中进行了电视辅助纵隔镜检查。入组的可手术切除的非小细胞肺癌患者是PET-CT分期为cT1-T3N1M0的患者。超声内镜研究纳入了2009年至 2013 年3个研究中心的患者,电视纵隔镜研究纳入了2014 年至 2017 年9个研究中心的连续病例。
这两项研究入组的患者需要满足以下条件:外科手术可切除的非小细胞肺癌、经过FDG-PET-CT评估临床分期为N1淋巴结转移的患者。根据IASLC淋巴结分区图N1站(10组-14组)淋巴结肿大(定位为CT上淋巴结短径≥10 mm)或者N1站淋巴结FDG-PET为阳性的患者[11]。如果淋巴结的FDG摄取高于纵隔血管血流中的背景摄取,则认为FDG-PET上淋巴结呈阳性。允许纳入临床T分期中的T1、T2和经过筛选的T3(即肿瘤直径>7cm,侵犯胸壁,或原发肿瘤所在同一肺叶内出现其他转移结节的T3)(TNM第7版分期)。既往接受过肺癌治疗、不能手术切除疾病、cT4或cT3期中央型肿瘤(即侵犯纵隔胸膜、侵犯膈神经或壁层心包、主支气管肿瘤距主隆突小于2 cm)、合并FDG阳性摄取纵隔淋巴结或逐渐增大的纵隔淋巴结、远处转移 (cM1)或已经对纵隔淋巴结进行过EBUS评估的患者被排除在这两项研究之外。
超声内镜检查
纵隔超声内镜检查采用专用的超声支气管镜或超声食管镜完成。每个中心的超声支气管镜和超声食管镜检查均由同一名内镜医生在一次检查中同期完成。左上叶原发肿瘤至少需要探查2L-4L-7三站,左下叶肿瘤需要探查4L-7-8-9四站,右肺肿瘤需要探查2R-4R-7三站。对于短径大于5 mm的淋巴结,实时超声引导下采用22G穿刺活检针至少取样两次,根据 IASLC 淋巴结图进行标记并送病理检查。
经颈纵隔镜检查
第一项研究中,超声内镜阴性后进行纵隔镜检查,纵隔镜检查是第二项研究中的主要有创纵隔淋巴结分期手段,该检查由经验丰富的胸外科医生在特定的胸外科手术室进行。根据欧洲胸心外科协会(ESTS)指南,所有可见的纵隔淋巴结都应采样,至少包括4L-4R-7三站淋巴结,可以采用电视辅助纵隔镜淋巴结清扫(VAMLA)。它的适应证取决于外科医生的判断,在标准的纵隔镜检查中,不同部位的纵隔淋巴结通过采样评估,不一定完全切除。在电视辅助纵隔镜检查中,隆突下淋巴结和右侧气管旁淋巴结通常连同周围脂肪一起完整切除,左侧气管旁淋巴结切除需要避免左侧喉返神经损伤。电视辅助胸腔手术(VATS)或胸骨旁纵隔镜检查不被作为术前纵隔淋巴结分期的手段。
外科手术
如果有创纵隔淋巴结分期为阴性,则患者接受外科手术治疗,通过术中纵隔淋巴结清扫进行病理验证。通常采用VATS或开胸手术进行纵隔淋巴结清扫,淋巴结清扫遵循ESTS指南所推荐[12]。
研究终点
主要终点是通过有创纵隔分期技术检测纵隔淋巴结转移(N2淋巴结转移)的敏感性,第一项研究采用的是超声内镜,第二项研究采用的是纵隔镜或电视辅助纵隔镜。敏感性被定义为通过相应的有创纵隔淋巴结分期技术进行纵隔分期阳性的患者占所有纵隔淋巴结肿大患者的比例。
纵隔淋巴结清扫术(通过开胸或VATS手术)被认为是有创纵隔淋巴结分期后有无确定纵隔淋巴结转移的参考标准。次要终点是阴性预测值(NPV)和N2/3淋巴结转移发生率的评估。
统计分析
所有入组患者的敏感性、纵隔淋巴结阳性发生率和阴性预测值均在常规治疗的基础上进行评估。对于缺少参考标准的患者(即有创分期为阴性但未行手术治疗),使用多重插补分析来估计所有受试者的敏感性、纵隔淋巴结阳性发生率和阴性预测值。P值小于0.05被认为有统计学意义。
研究结果
第一项超声内镜研究从2009年到2013年连续入组了100名患者[9],第二项纵隔镜研究在2014年至2017年期间入组了105名患者[10]。两项研究的患者临床特征见表1。
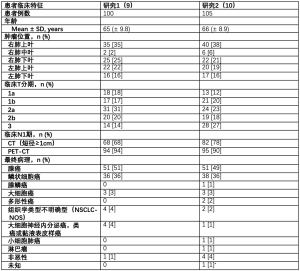
Full table
研究1:超声内镜检查
超声内镜纵隔淋巴结活检中位数目为2.1个。超声内镜(n=100)在10% (n=10)的患者中检测到纵隔淋巴结转移(N2阳性)。除此之外,另有14名患者在后续诊疗过程中发现N2淋巴结转移,分别是在后续纵隔镜检查(n=7/75)、手术切除后(n=1/10)或纵隔镜检查阴性后手术切除所发现(n=6/67)。
在超声内镜检查所漏诊的患者中,12名患者为单站N2转移,2名患者为多站N2转移。漏诊的纵隔淋巴结部位分别为:第7站(n=5)、第4R站(n=4)、第2R站(n=1)、第 4L站(n=2)、第8站(n=1)和第5站(n=3)。其中超声内镜漏诊的6名患者在后续纵隔镜检查也没有发现N2阳性,而是手术切除后被证实,分别是:第7站(n=1)、第4R站(n=1)、第4L站(n=1)和第5站(n =3)。6名患者未接受切除手术,其中5名患者为超声内镜检查阴性,1名患者超声内镜检查和纵隔镜检查均为阴性。
单独采用超声内镜对临床N1患者进行纵隔淋巴结分期的敏感性为38 % ( 95 % CI:18 %~ 57 % );如果超声内镜检查为阴性,则行纵隔镜检查确认,敏感性提高到73%(95% CI:55%~91%)[9]。超声内镜的阴性预测值(NPV)为 81%(95% CI:71%~91%),而超声内镜联合纵隔镜检查的阴性预测值(NPV)为 91%(95% CI:83%~98%)。临床N1阳性患者发生纵隔淋巴结转移的总体概率为24%。根据多重插补分析,估计需要治疗的人数 (NNT) 是每10 名纵隔镜检查的患者中,有1例在超声内镜检查阴性后会被发现存在纵隔淋巴结转移。
研究 2:电视辅助纵隔镜检查
纵隔镜检查淋巴结活检平均个数为3.9个。在105名接受纵隔镜检查的患者中,20名患者纵隔淋巴结为阳性。31%(n=33)的患者接受了电视辅助纵隔镜淋巴结切除(VAMLA)。2名患者未能完成手术,其中1名患者由于严重的脊柱后凸畸形,无法插入纵隔镜,另一名患者由于手术过程中气管软化和通气问题而提前终止检查。4名患者(4%)发生了与纵隔镜(VAM)相关的严重不良事件:1例出血大于200ml,1例发生无症状切口感染,2例出现可逆性神经麻痹。
83名患者接受了外科手术切除,其中7名患者发现阳性纵隔淋巴结,其中1例是在纵隔镜检查过程中提前终止的患者。漏诊的纵隔淋巴结转移患者中,单站N2阳性为5例,多站N2阳性2例。分别位于7组(n=5)、4R组(n=2)和6组(n=2)。
其中2例患者纵隔镜检查阴性后未接受外科手术评估。在纵隔镜淋巴结活检或切除后为阴性的83名患者中,6名患者在手术切除时病理为N2/N3。
根据多重插补意向治疗分析,纵隔镜淋巴结活检或切除的敏感性为73%(95% CI: 54%~86%), 阴性预测值为92%(95% CI: 83%~97%),纵隔淋巴结转移率为26%(95% CI:18%~35%)(表2)。

Full table
讨论
很少有文献报道临床分期为N1、可手术切除的非小细胞肺癌患者最终病理分期情况。Hishida和Watanabe等报道,30%~37% 根据CT检查临床分期为N1的患者,纵隔镜检查时淋巴结阳性[1,2]。Kim等报道包括了99名根据FDG-PET检查临床分期为N1的患者中,肺切除术和纵隔淋巴结清扫术发现病理性N2淋巴结转移概率为19%[4]。Mizuno等在一项164名患者的回顾性研究中发现,放射学诊断为临床分期N1的非小细胞肺癌患者,N2阳性的发生率为26%[13]。
在我们两项关于侵入性纵隔淋巴结分期的前瞻性研究中,共有超过200名患者入组,我们发现四分之一经PET-CT临床分期为N1的肺癌患者,在侵入性分期和/或切除后最终确认为N2阳性。纵隔镜在这些患者中检测阳性纵隔淋巴结的敏感性为73%。单独超声内镜检查的敏感性达到38%。超声内镜的阴性预测值为81%。因此,内镜检查结果为阴性的患者,在接受外科手术纵隔淋巴结清扫的纵隔淋巴结阳性的概率为19%,纵隔镜检查为8%。
目前的指南建议对临床分期为N1的患者和影像学检查纵隔淋巴结呈阴性的患者进行侵入性术前分期。然而,关于首选纵隔镜还是超声内镜尚无明确推荐[6],这是基于对包括临床分期为I-III期肺癌患者亚组分析的结果[14]。绝大多数患者合并N2疾病,只有少数患者影像学显示纵隔正常而临床分期为N1 [7,8,15]。
在隐匿性的N2阳性率低于30%,且超声内镜N2阳性敏感性为38%的情况下,先行超声内镜检查,然后进行纵隔镜检查(如果超声内镜检查阴性)的双重方法被认为不符合成本效益[9]。在第一项包含100名患者的超声内镜检查研究中,纵隔淋巴结阳性的患者为10例,其余90名患者应根据研究计划接受纵隔镜检查。需要治疗的人数(NNT)相当于10次额外的纵隔镜检查才能发现1例N2淋巴结阳性的患者。该患者组中,是否可以省略超声内镜检查,而直接选择电视纵隔镜检查作为手术前的纵隔淋巴结分期存在一定的争议。
是否应该对临床分期为N1的患者进行侵入性分期检查,是另一个讨论点,并不是这些研究的一部分。一些人认为PET-CT阴性后不需要进行侵入性纵隔分期,因为对于术前未能发现但手术切除后证实的N2患者与临床分期为N2的患者,无论是术后辅助治疗还是新辅助治疗,患者的生存率都没有差别[17]。分期偏倚是导致肿瘤患者的生存获益不同的原因,治疗开始前的正确分期不仅对于科学研究中不同患者的对比至关重要,而且可以针对不同的患者制定个体化的手术或非手术治疗方案,具有潜在的个体获益且可以避免过渡治疗。在这些研究中,侵入性分期时1/3的患有N2或N3站淋巴结阳性[9,10]。此外,与术后相比,更多的患者能够在术前接受完整的新辅助治疗[18]。随着免疫治疗的出现,并且免疫治疗正被用于可切除的肺癌的研究,人们提出了术前治疗的优势理论[19]。目前的ESTS和ESMO 指南仍然推荐对临床分期为N1的患者进行侵入性分期[6,20]。
两项研究的结合并不等于随机对照试验。虽然纳入标准和患者特征相似,但参与这两项研究的不同研究中心都有时间间隔。在第一项关于超声内镜检查的前瞻性队列研究中得出其敏感性低的结果后,继续进行随机试验似乎是不符合伦理的。由于纵隔镜检查是在第一项研究超声内镜检查阴性后进行,出现了一些可能会改变纵隔镜灵敏度的患者,因此很明显需要进行第二项研究。
关于纵隔镜检查的第二项研究入组率比预期的要慢,这导致置信区间的宽度比预期略宽。可能一些潜在患者在研究期间并未包括在内,原因是为了进行纵隔淋巴结分期而转诊进行超声内镜检查,这是一项排除标准。其次,由于该研究是由愿意参与前瞻性侵入性分期研究的机构进行,因此结果可能与日常实践中手术切除前分期不同[21]。
第二项研究中有31%的患者纵隔镜检查为电视辅助纵隔镜淋巴结清扫。理论上纵隔镜检查和电视辅助纵隔镜淋巴结清扫是不同的程序。实际上,由于某些部位纵隔淋巴结被完全切除,而其他部位淋巴结在同一操作中被采样,因此纵隔镜检查介于采样和清扫之间。虽然电视辅助纵隔镜下淋巴结清扫超越了纯粹的诊断程序,并且可能是完整淋巴结清扫术的第一步,但不应将电视辅助纵隔镜下淋巴结清扫与通过5至8厘米的颈部切口进行的经颈扩大纵隔淋巴结清扫术(TEMLA)混淆,TEMLA包括胸骨柄悬吊,进行除了9组和最远端4L组的完整纵隔淋巴结清扫术[22]。然而,假阴性结果都是在标准纵隔镜采样之后发现的,在电视辅助纵隔镜淋巴结清扫之后没有发现假阴性结果。在2名患者中,纵隔镜采样或电视辅助纵隔镜淋巴结清扫均未能取到病理为阳性的纵隔淋巴结(均为6组淋巴结)。因此,电视辅助纵隔镜淋巴结清扫的结果相当完美,并未出现假阴性结果,也没有明显并发症。但病例数较少,无法将标准纵隔镜检查与电视辅助纵隔镜淋巴结清扫进行比较,但我们认为,对于临床分期为N1且具有高风险纵隔淋巴结转移的患者,电视辅助纵隔镜下淋巴结清扫有助于纵隔淋巴结的完整切除。
总之,我们前瞻性地分析了临床分期N1的非小细胞肺癌患者,手术切除前使用超声内镜和纵隔镜采样(或淋巴结清扫)进行病理分期的情况。我们证实1/4的患者为N2阳性,并发现纵隔镜采样(或淋巴结清扫)的敏感性为73%。由于超声内镜单独检测纵隔淋巴结的敏感性不能令人满意,我们主张选择电视辅助纵隔镜下淋巴结清扫作为临床分期为N1的非小细胞肺癌患者手术切除前纵隔淋巴结分期的首选技术。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors Marcin Zielinski and Qingdong Cao for the series “Mediastinoscopic Surgery” published in Mediastinum. The article has undergone external peer review.
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/med.2019.12.01). The series “Mediastinoscopic Surgery” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Watanabe S, Asamura H, Suzuki K, et al. Problems in diagnosis and surgical management of clinical N1 non-small cell lung cancer. Ann Thorac Surg 2005;79:1682-5. [Crossref] [PubMed]
- Hishida T, Yoshida J, Nishimura M, et al. Problems in the current diagnostic standards of clinical N1 non-small cell lung cancer. Thorax 2008;63:526-31. [Crossref] [PubMed]
- Cerfolio RJ, Bryant AS, Ojha B, et al. Improving the inaccuracies of clinical staging of patients with NSCLC: a prospective trial. Ann Thorac Surg 2005;80:1207-13; discussion 1213-4. [Crossref] [PubMed]
- Kim D, Choi YS, Kim HK, et al. Heterogeneity of clinical n1 non-small cell lung cancer. Thorac Cardiovasc Surg 2014;62:103-8. [Crossref] [PubMed]
- Detterbeck FC, Lewis SZ, Diekemper R, et al. Executive summary: diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013;143:7S-37S.
- De Leyn P, Dooms C, Kuzdzal J, et al. Revised ESTS guidelines for preoperative mediastinal lymph node staging for non-small-cell lung cancer. Eur J Cardiothorac Surg 2014;45:787-98. [Crossref] [PubMed]
- Annema JT, van Meerbeeck JP, Rintoul RC, et al. Mediastinoscopy vs endosonography for mediastinal nodal staging of lung cancer: a randomized trial. JAMA 2010;304:2245-52. [Crossref] [PubMed]
- Yasufuku K, Pierre A, Darling G, et al. A prospective controlled trial of endobronchial ultrasound-guided transbronchial needle aspiration compared with mediastinoscopy for mediastinal lymph node staging of lung cancer. J Thorac Cardiovasc Surg 2011;142:1393-400.e1. [Crossref] [PubMed]
- Dooms C, Tournoy KG, Schuurbiers O, et al. Endosonography for mediastinal nodal staging of clinical N1 non-small cell lung cancer: a prospective multicenter study. Chest 2015;147:209-15. [Crossref] [PubMed]
- Decaluwé H, Dooms C, D'Journo XB, et al. Mediastinal staging by videomediastinoscopy in clinical N1 non-small cell lung cancer: a prospective multicentre study. Eur Respir J 2017; [Crossref] [PubMed]
- Rusch VW, Asamura H, Watanabe H, et al. The IASLC lung cancer staging project: a proposal for a new international lymph node map in the forthcoming seventh edition of the TNM classification for lung cancer. J Thorac Oncol 2009;4:568-77.
- Lardinois D, De Leyn P, Van Schil P, et al. ESTS guidelines for intraoperative lymph node staging in non-small cell lung cancer. Eur J Cardiothorac Surg 2006;30:787-92. [Crossref] [PubMed]
- Mizuno T, Arimura T, Kuroda H, et al. Histological type predicts mediastinal metastasis and surgical outcome in resected cN1 non-small cell lung cancer. Gen Thorac Cardiovasc Surg 2017;65:519-26. [Crossref] [PubMed]
- Tournoy KG, Keller SM, Annema JT. Mediastinal staging of lung cancer: novel concepts. Lancet Oncol 2012;13:e221-9. [Crossref] [PubMed]
- Kang HJ, Hwangbo B, Lee GK, et al. EBUS-centred versus EUS-centred mediastinal staging in lung cancer: a randomised controlled trial. Thorax 2014;69:261-8. [Crossref] [PubMed]
- Thomas DC, Arnold BN, Rosen JE, et al. The significance of upfront knowledge of N2 disease in non-small cell lung cancer. World J Surg 2018;42:161-71. [Crossref] [PubMed]
- Lim E, Harris G, Patel A, et al. Preoperative versus postoperative chemotherapy in patients with resectable non-small cell lung cancer: systematic review and indirect comparison meta-analysis of randomized trials. J Thorac Oncol 2009;4:1380-8. [Crossref] [PubMed]
- Felip E, Rosell R, Maestre JA, et al. Preoperative chemotherapy plus surgery versus surgery plus adjuvant chemotherapy versus surgery alone in early-stage non-small-cell lung cancer. J Clin Oncol 2010;28:3138-45. [Crossref] [PubMed]
- Ghysen K, Vansteenkiste J. Immunotherapy in patients with early stage resectable nonsmall cell lung cancer. Curr Opin Oncol 2019;31:13-7. [Crossref] [PubMed]
- Postmus PE, Kerr KM, Oudkerk M, et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017;28:iv1-21. [Crossref] [PubMed]
- Smulders SA, Smeenk FW, Janssen-Heijnen ML, et al. Surgical mediastinal staging in daily practice. Lung Cancer 2005;47:243-51. [Crossref] [PubMed]
- Zieliński M. Transcervical extended mediastinal lymphadenectomy: results of staging in two hundred fifty-six patients with non-small cell lung cancer. J Thorac Oncol 2007;2:370-2. [Crossref] [PubMed]

闵先军
中国航天科工集团七三一医院胸外科副主任,外科第三支部书记,师从王俊院士和李辉教授,四次登上国际胸外科专业顶级大会的舞台(14th WCLC、50th STS、13th ISSS 和2020年ASCO年会);曾获得北京市海淀区“知识型职工标兵”、北京市海淀区“学习之星”、“首都市民学习之星”等荣誉称号。(更新时间:2021/9/5)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Decaluwé H, Dooms C. Invasive mediastinal staging by endosonography or video-assisted mediastinoscopy in PET-CT clinical N1 non-small cell lung cancer. Mediastinum 2020;4:6.


